培训课程|MDR临床评价及技(jì )术文(wén)档培训
发布时间 :
2025/04/18
在当今瞬息万变的商(shāng)业环境中(zhōng),我们深信,持续的學(xué)习与发展是企业赢得未来的关键驱动力。知识的积累与创新(xīn)能(néng)力的提升,不仅是个人成長(cháng)的基石,更是企业实现突破与卓越的核心动力。凭借我们在全球范围内的广泛资源与在医(yī)疗科(kē)技(jì )领域的深厚积淀,我们致力于為(wèi)企业量身打造精(jīng)准的培训解决方案。我们的专家团队由行业领军者与实战经验丰富的导师组成,结合前沿的管理(lǐ)理(lǐ)念与实战案例,為(wèi)企业提供全方位的支持与指导。通过系统化的培训与战略规划,我们助力企业在激烈的市场竞争中(zhōng)保持领先,实现可(kě)持续的長(cháng)期发展,迈向更加辉煌的未来。
课程介绍:
本期為(wèi)期4天(2+2)的专业培训课程将深入解析欧洲医(yī)疗器械法规(MDR)框架下的临床评价与技(jì )术文(wén)档的核心要求。
在临床评价模块,课程将系统阐述这一确保医(yī)疗器械安(ān)全与性能(néng)的关键流程。临床评价作(zuò)為(wèi)预先规划的系统化评估过程,旨在验证医(yī)疗器械对MDR的合规性,并持续证明其风险收益比的可(kě)接受性。作(zuò)為(wèi)MDR要求的重要技(jì )术文(wén)件,临床评价报告在CE认证过程中(zhōng)具(jù)有(yǒu)决定性作(zuò)用(yòng)。本模块课程将深度解读MDR临床评价条款,结合典型案例,重点剖析临床数据收集方法与MDR临床评价的评审要点。
技(jì )术文(wén)档模块将全面解析MDR 2017/745法规下的技(jì )术文(wén)档编制要求。通过本模块學(xué)习,您将掌握技(jì )术文(wén)档的详细编写规范,准确识别现有(yǒu)文(wén)档与MDR要求的差距,并制定切实可(kě)行的改进方案,确保技(jì )术文(wén)档的完整性和合规性。本模块课程将依据MDR最新(xīn)要求进行重点讲解与指导。
本次课程采用(yòng)"理(lǐ)论讲解+案例分(fēn)析+实操指导"的教學(xué)模式,旨在帮助學(xué)员全面提升MDR合规能(néng)力,為(wèi)医(yī)疗器械产(chǎn)品顺利通过CE认证奠定坚实基础。
课程对象:
医(yī)疗器械生产(chǎn)企业负责法规注册、研发、临床、售后监督、不良事件报告和质(zhì)量管理(lǐ)體(tǐ)系的相关人员。
课程时间:
欧盟MDR临床评价课程
2025年04月26日-04月27日,9:00-17:00
欧盟MDR技(jì )术文(wén)档课程
2025年04月28日-04月29日,9:00-17:00
课程地点:
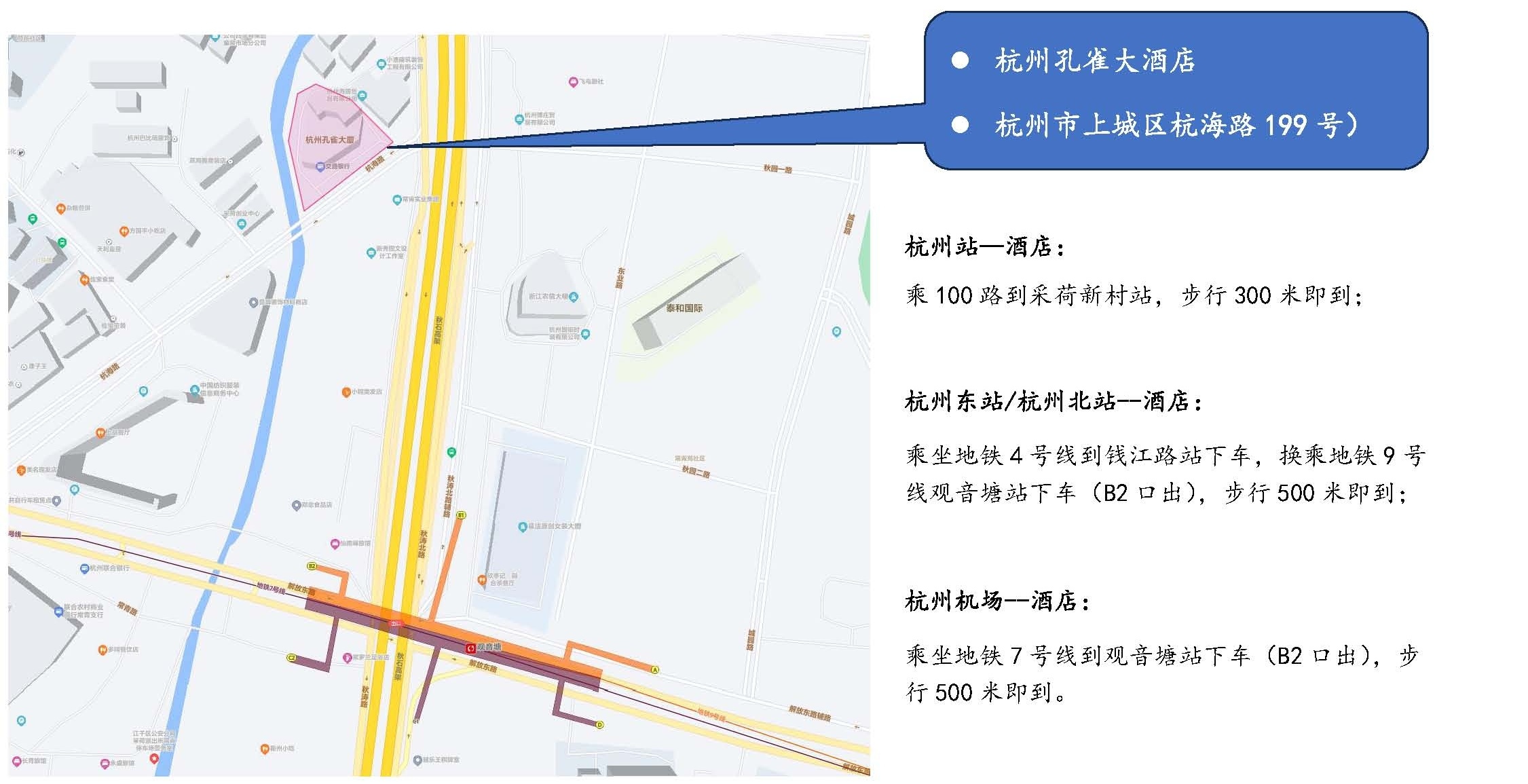
杭州孔雀大酒店(diàn)(杭州市上城區(qū)杭海路199号)
课程大纲:
Day 1-2(2025年04月26日-04月27日)
主题:欧盟MDR临床评价深度解析与实践
模块一:临床评价基础与框架
临床评价概述:定义、目标与重要性
临床评价在医(yī)疗器械生命周期中(zhōng)的关键作(zuò)用(yòng)
临床证据的核心价值及其在MDR合规中(zhōng)的意义
模块二:临床评价流程与实施
临床评价的触发条件与实施时机
利益相关者角色与职责:制造商(shāng)、公(gōng)告机构、临床专家等
等同产(chǎn)品的使用(yòng)原则与限制
模块三:临床数据管理(lǐ)
临床数据的类型与获取途径
数据收集、分(fēn)析与评估方法
文(wén)献回顾流程:数据库选择、检索策略设计与关键词优化
数据审阅与问题定义:如何构建高效的文(wén)献检索框架
模块四:临床评估计划与报告(CEP/CER)
临床评估计划(CEP)的制定与关键要素
临床评估报告(CER)的结构与内容要求
CER编写流程与责任分(fēn)工(gōng)
模块五:SOTA与风险效益评估
最新(xīn)技(jì )术水平(SOTA)的定义与应用(yòng)
性能(néng)与安(ān)全性分(fēn)析
风险-效益评估方法与实践
模块六:常见问题与案例分(fēn)析
临床评价中(zhōng)的常见错误与规避策略
典型案例解析与经验分(fēn)享
Day 3-4(2025年04月28日-04月29日)
主题:欧盟MDR技(jì )术文(wén)档编写与审查实務(wù)
模块一:MDR技(jì )术文(wén)档框架与审查流程
MDR技(jì )术文(wén)档的结构与核心要求
文(wén)档审查流程:形式审查与内容审查
模块二:技(jì )术文(wén)档核心要素解析
通用(yòng)安(ān)全与性能(néng)要求(GSPR)文(wén)件编写与审查
器械描述文(wén)件的关键内容与合规要点
制造商(shāng)提供信息的规范与审查标准
模块三:产(chǎn)品设计与制造文(wén)档
产(chǎn)品设计文(wén)件的合规性要求
制造过程文(wén)件的编制与审查
持续改进管理(lǐ)體(tǐ)系的构建与实施
模块四:风险管理(lǐ)与临床前测试文(wén)档
风险管理(lǐ)文(wén)档的编写与审查要点
临床前安(ān)全性能(néng)测试报告的合规性要求
生物(wù)相容性研究资料的准备与审查
模块五:专项研究资料审查
可(kě)用(yòng)性研究资料的编写与审查
灭菌确认资料的合规性要求
包装(zhuāng)运输验证资料的准备与审查
老化试验资料的要求与审查要点
培训教师:
全國(guó)医(yī)用(yòng)電(diàn)器标准化技(jì )术委员会委员
第7届全國(guó)医(yī)用(yòng)電(diàn)器标准化技(jì )术委员会委员(TC10)
GB 9706.1-2020 《医(yī)用(yòng)電(diàn)气设备 第1部分(fēn):基本安(ān)全和基本性能(néng)的通用(yòng)要求》标准主要起草(cǎo)人及标准解读编委会编委
原头部器械企业法规负责人、事业部负责人、认证签证官;GB9706系列标准、GB4943系列标准签字授权人
培训费用(yòng):
RMB 7,480/人(4天课程)
*费用(yòng)说明*
- 以上价格均已含税(1% VAT)
- 以上费用(yòng)含教材、证书及培训当天的午餐及茶歇。
- 不含住宿费和晚餐费用(yòng)。
- 可(kě)按需报名(míng)相关主题课程。
- 所有(yǒu)参课學(xué)员,将获得我司颁发的培训证书。
联系方式:
联系人:侯帅 電(diàn)话:185 0008 8131(微信同步) 邮箱:Shuai.Hou@kiwa.cn
联系人:郭飞 電(diàn)话:151 0112 2483(微信同步) 邮箱:Fei.Guo@kiwa.cn
联系人:张莹 電(diàn)话:135 0116 3414(微信同步) 邮箱:Ying.Zhang@kiwa.cn
北京國(guó)英卓越教育科(kē)技(jì )有(yǒu)限公(gōng)司
2025年4月18日
交通提示:
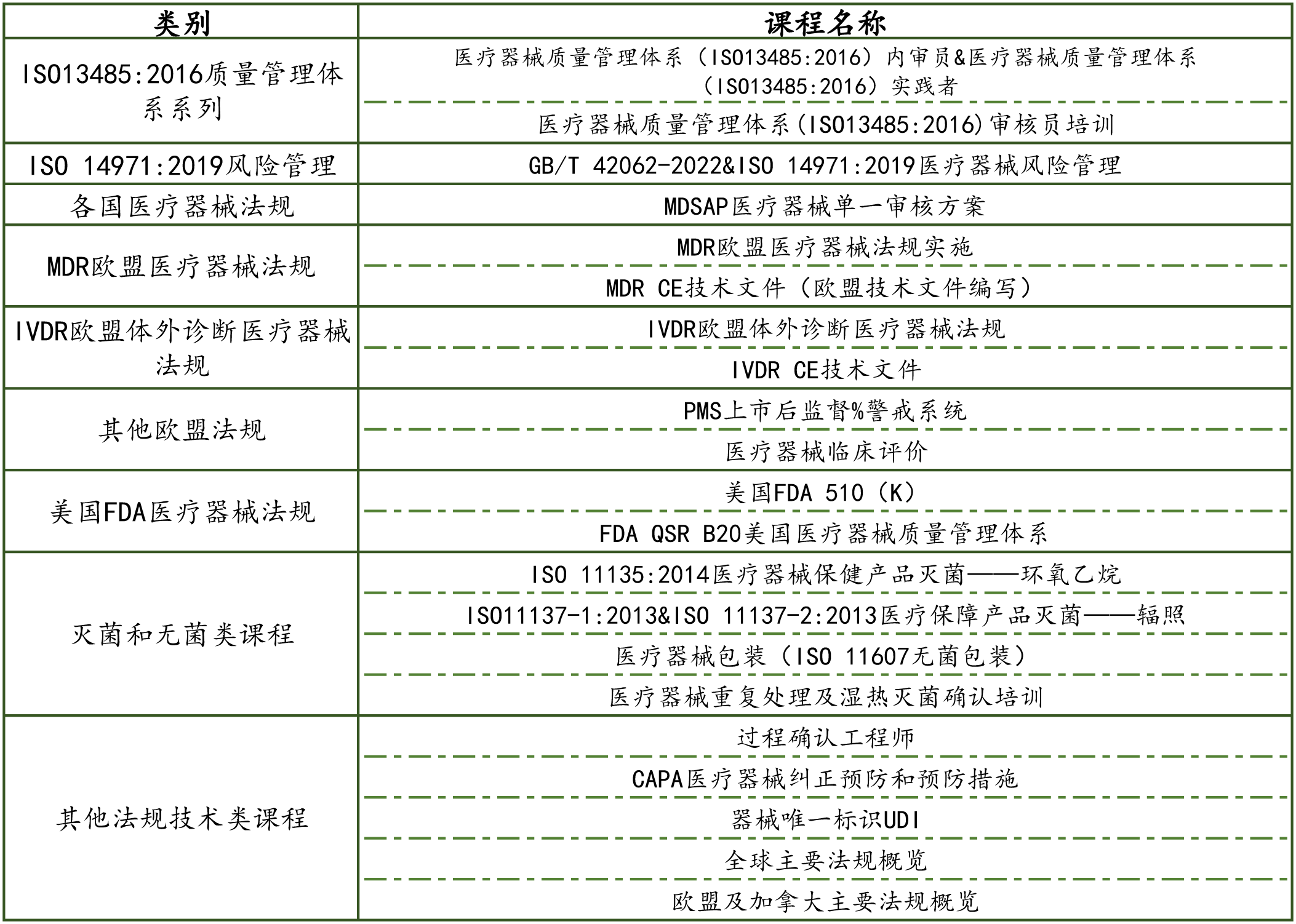
日程安(ān)排:

关键词 :
上一页(yè)
上一页(yè)
相关新(xīn)闻
2025-01-13
2025-04-18


